UBND HUYỆN TRẢNG BÀNG
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO
-------------------------
KIỂM TRA HỌC KÌ I NĂM HỌC 2017 – 2018
Môn : HÓA HỌC 9
Thời gian: 60 phút ( không kể thời gian phát đề )
------------------------------------------------------------
( Đề thi có 02 trang, thí sinh không phải chép đề vào giấy thi )
ĐỀA. TRẮC NGHIỆM: (2 điểm)Câu 1: Dãy chất gồm các oxit bazơ là:
A. CuO, NO, MgO, CaO.
B. CuO, CaO, MgO, Na
2O.
C. CaO, CO
2, K
2O, Na
2O.
D. K
2O, FeO, P
2O
5, Mn
2O
7.
Câu 2: Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit ?
A . CO
2 B. SO
2 C. N
2 D. O
3 Câu 3: Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 20,4 B. 1,36 g C. 13,6 g D. 27,2 g
Câu 4: Phản ứng nào dưới đây là phản ứng trao đổi ?
A. 2Na + 2H
2O → 2NaOH + H
2 B. BaO + H
2O → Ba(OH)
2 C. Zn + H
2SO
4 → ZnSO
4 +H
2 D. BaCl
2+H
2SO
4 → BaSO
4 + 2HCl
Câu 5: Khi thả một cây đinh sắt sạch vào dung dịch CuSO
4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Câu 6: Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với:
A. Dung dịch NaOH dư B. Dung dịch H
2SO
4 loãng
C. Dung dịch HCl dư D. Dung dịch HNO
3 loãng .
Câu 7: Dãy phi kim tác dụng với oxi tạo thành oxit axit là:
A. S, C, P. B. S, C, Cl
2. C. C, P, Br
2. D. C, Cl
2, Br
2.
Câu 8: X là nguyên tố phi kim có hoá trị III trong hợp chất với khí hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65 %. X là nguyên tố:
A. C. B. S. C. N. D. P.
B. TỰ LUẬN:( 8 điểm ) Câu 9: (1 điểm). Hãy cho biết hiện tượng xảy ra khi nhúng một viên kẽm vào:
a. Dung dịch CuSO
4b. Dung dịch HCl
Câu 10: (1 điểm). Bằng phương pháp hóa học hãy nhận biết dung dịch các chất chứa trong các lọ bị mất nhãn sau: HCl, KOH, NaNO
3, Na
2SO
4.
Câu 11: (2 điểm). Hãy lập phương trình hóa học của các phản ứng sau:
a. Al + Cl
2 →
b. Cu + AgNO
3 →
c. Na
2O + H
2O →
d. FeCl
3 + NaOH →
Câu 12: (1 điểm). Hoà tan hết 2,3g Na kim loại vào 97,8g nước . Hãy tính nồng độ % của dung dịch thu được sau phản ứng ?
Câu 13: (1 điểm). Cho 10,5g hỗn hợp 2 kim loại Cu và Zn vào dd H
2SO
4 loãng dư, người ta thu được 2,24 lít khí (đktc). Hãy tính thành phần % theo khối lượng của Cu và Zn lần lượt là:
Câu 14: (1 điểm). Hoà tan hoàn toàn 3,25g một kim loại X (hoá trị II) bằng dung dịch HCl thu được 1,12 lít khí H
2 (ở đktc). Hãy xác định tên kim loại X ?
Câu 15: (1 điểm). Ngâm lá sắt có khối lượng 56gam vào dung dịch AgNO
3 , sau một thời gian lấy lá sắt ra rửa nhẹ cân được 57,6 gam. Hãy tính khối lượng Ag sinh ra sau phản ứng?
( Cho: N=14, Na=23, Cu=64, Zn=65, Ag=108, O=16 )
-----Hết-----
ĐÁP ÁN – BIỂU ĐIỂM KIỂM TRA HỌC KÌ I
Môn: Hóa học 9 Năm học: 2017– 2018
A. TRẮC NGHIỆM: (2 điểm)Chọn đúng mỗi câu được 0,25đ
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | B | B | C | D | D | A | A | C |
B. TỰ LUẬN:( 8 điểm ) | CÂU | ĐÁP ÁN | ĐIỂM |
| 9:1điểm | 9. a. Kẽm tan một phần, có lớp chất rắn màu đỏ bám vào viên kẽm, dung dịch màu xanh nhạt dần.
PTHH: Zn + CuSO4 → ZnSO4 + Cu↓
b. Kẽm tan và có sủi bọt khí.
PTHH: Zn + 2HCl → ZnCl2 + H2↑ | 0,5
0,5 |
| 10:1điểm | 10.
- Lấy mỗi lọ 1 ít dung dịch làm mẫu thử. Cho quỳ tím lần lượt vào từng mẫu thử.
+ Mẫu làm quỳ tím hóa đỏ là dung dịch HCl.
+ Mẫu làm quỳ tím hóa xanh là dung dịch KOH.
+ Mẫu không đổi màu quỳ tím là dung dịch NaNO3 và Na2SO4.
- Cho dung dịch BaCl2 lần lượt vào 2 mẫu thử còn lại.
+ Mẫu nào có tạo kết tủa trắng là dung dịch Na2SO4.
PTHH: BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
+ Mẫu còn lại là NaNO3. |
0,25
0,25
0,25
0,25 |
| 11:2điểm | 11.a. 2Al + 3Cl2 → 2AlCl3
b. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
c. Na2O + H2O → 2NaOH
d. FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl | 0,5
0,5
0,5
0,5 |
| 12:1điểm | 12.
nNa = = 0,1 (mol) | 0,5
0,5 |
| |
| 13:1điểm | 1.Gọi công thức tinh thể cần tìm là: BaCl2.nH2O. 208 + 18n mH2O = n.18=18n (g) %H2O = 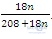 .100 =14,75 => 1800n = 14,75.(208 + 18n) => n = 2 Vậy: Công thức của tinh thể là:BaCl 2.2H 2O. |
0,5
0,5 |
2. Gọi x, y lần lượt là số mol của A và B. - Phản ứng với HCl: 2A + 2HCl → 2ACl + H 2 x x x 0,5x (mol) 2B + 2HCl → 2BCl + H 2 y y y 0,5y (mol) Khối lượng muối khan: a = x(A + 35,5) + y(B + 35,5 ) = Ax + By + 35,5(x + y) (*) -Phản ứng với axit H 2SO 4: 2A + H 2SO 4 → A 2SO 4 + H 2 x 0,5x 0,5x 0,5x (mol) 2B + H 2SO 4 → B 2SO 4 + H 2 y 0,5y 0,5y 0,5y (mol) Khối lượng muối khan: b = 0,5x(2A + 96) + 0,5y(2B + 96 ) = Ax + By + 48(x + y) (**) Lấy (**) – (*), ta được: (x + y).(48 – 35,5) = b – a => x + y = 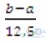 |
0,5
0,5
0,5
0,5
|
| 14:1điểm | Giả sử a =200 gam.
Gọi x, y, z lần lượt là số mol Fe, FeO, Fe2O3 trong 100 gam.
-Hòa tan 100 gam hỗn hợp trên bằng dung dịch HCl dư
Fe + 2HCl → FeCl2 + H2
x 2x x x
FeO + 2HCl → FeCl2 + H2O
y 2y y y
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
z 6z 2z 3z
Ta có: 2x= 1 (*)
- Khử 100 gam hỗn hợp trên bằng H2 dư
FeO + H2 → Fe + H2O
y y y y
Fe2O3 + 3H2 → 2Fe + 3H2O
z 3z 2z 3z
Ta có: 18y + 54z = 21,15 (**)
56x + 72y + 160z = 100(***)
Từ(*), (**), (***) ta có hệ phương trình:
 |
0,5
0,5
0,5
0,5
0,5
0,5
|
| 15:1điểm | Các phương trình hóa học:
Cốc A: Mg + H2SO4 → MgSO4 + H2 (1)
Cốc B: M + 2HCl → MCl2 + H2 (2)
nMg = 0,27 (mol)
nM = 6,16/M (mol)
Theo (1): nH2 = nMg = 0,27 (mol)
=> mH2 = 0,27.2 = 0,54 (g)
Theo (2): nH2 = nM = 6,16/M (mol)
=> mH2 = 6,16/M.2 = 12,32/M (g)
Theo giả thuyết: Cân thăng bằng nên khối lượng dung dịch sau phản ứng ở cốc A = khối lượng dung dịch sau phản ứng ở cốc B.
ó mMg + mddHCl - mH2(1) = mM + mddH2SO4 - mH2(2)
ó mMg - mH2(1) = mM - mH2(2)
(Vì ban đầu cân thăng bằng nên: mddHCl = mddH2SO4)
ó 6,48 – 0,54 = 6,16 - 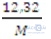
=> M = 56
Vậy: Kim loại hóa trị II là Fe. |
0,5
0,5
0,5
0,5
|
Lưu ý: Học sinh có thể giải theo cách khác, nếu đúng vẫn được điểm tối đa cho câu đó.
------Hết------