Bài 1. Viết phương trình hóa học biểu diễn phản ứng của hiđro với các chất: O2, Fe2O3, Fe3O4, PbO. Ghi rõ điều kiện phản ứng. Giải thích và cho biết mỗi phản ứng riêng thuộc loại gì?
Giải bài 1
Phương trình phản ứng:
2H2 + O2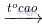 2H2O (1)
2H2O (1)
4H2 + Fe3O4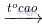 4H2O + 3Fe (2)
4H2O + 3Fe (2)
3H2 + Fe2O3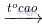 4H2O + 3Fe (3)
4H2O + 3Fe (3)
H2 + PbO 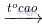 H2O + Pb (4)
H2O + Pb (4)
- Phản ứng (1) là phản ứng hóa hợp.
- Phản ứng (2), (3) và (4) là phản ứng thế.
- Cả 4 phản ứng đều là phản ứng oxi hóa – khử vì đều có đồng thời cả sự khử và sự oxi hóa.
Bài 2. Có 3 lọ đựng riêng biệt các chất khí sau: oxi, không khí và hiđro. Bằng thí nghiệm nào có thể nhận ta chất khí trong mỗi lọ?
Giải bài 2: Dùng một que đóm đang cháy cho vào mỗi lọ:
- Lọ cho que đóm sang bùng lên: lọ chứa oxi.
- Lọ không làm thay đổi ngọn lửa: lọ chứa không khí.
- Lọ làm que đóm cháy với ngọn lửa màu xanh mờ và có tiếng nổ lách tách nhẹ là lọ chứa hiđro (hoặc lọ còn lại chứa hiđro)
Bài 3. Cho dung dịch axit sunfuric loãng, nhôm và các dụng cụ thí nghiệm như hình 5.8.
Hãy chọn câu trả lời đúng trong các chất sau:

a. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí oxi.
b. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu không khí.
c. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí hiđro.
d. Có thể dùng để diều chế hiđro nhưng không thu được khí hiđro.
Giải bài 3: Câu c đúng (có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí hiđro).
Bài 4.
a. Lập phương trình hóa học của các phản ứng sau:
- Cacbon đioxit + nước → Axit cacbonic (H2CO3)
- Lưu huỳnh đioxit + nước → Axit sunfurơ (H2SO3)
- Kẽm + axit clohiđric → Kẽm clorua + H2
- Điphotpho + nước → Axit photphoric (H3PO4)
- Đồng (II) oxit + hiđro → Chì (Pb) + H2O
b. Mỗi phản ứng hóa học trên đây thuộc loại phản ứng nào? Vì sao?
Giải bài 4
a. Phương trình phản ứng.
CO2 + H2O → H2CO3 (1)
(kém bền)
SO2 + H2O → H2SO3 (2)
(kém bền)
Zn + 2HCl → ZnCl2 + H2O (3)
P2O5 + HCl → 2H3PO4 (4)
CuO + H2 → Cu + H2O (5)
b.
- Phản ứng (1), (2) và (4) là phản ứng kết hợp.
- Phản ứng (3) và (5) là phản ứng thế.
- Phản ứng (5) là phản ứng oxi hóa khử.
Bài 5
a. Hãy viết phương trình hóa học của các phản ứng giữa hiđro với hỗn hợp đồng (II) oxit, và sắt (III) oxit ở nhiệt độ thích hợp?
b. Trong các phản ứng hóa học trên, chất nào là chất khử, chất nào là chất oxi hóa? Vì sao?
c. Nếu thu được 6,00 gam hỗn hợp hai kim loại, trong đó có 2,80 gam sắt thì thể tích (ở đktc) khí hiđro vừa đủ cần dùng để khử đồng (II) oxi và sắt (III) oxit là bao nhiêu?
Giải bài 5
a. Phương trình phản ứng:
CuO + H2 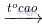 Cu + H2O (1)
Cu + H2O (1)
1mol 1mol 1mol 1mol
Fe2O3 + 3H2 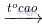 3H2O + 2Fe (2)
3H2O + 2Fe (2)
1mol 3mol 3mol 2mol
b.
- Chất khử là H2 vì chiếm oxi của chất khác;
- Chất oxi hóa: CuO, Fe2O3 vì nhường oxi cho chất khác.
c. Số mol đồng thu được là: nCu = (6 - 2,8)/64 = 0,5 (mol)
Số mol sắt là: nFe = 2,8/56 = 0,05 (mol)
Thể tích khí hiđro cần dùng để khử CuO theo phương trình phản ứng (1) là: nH2 = nCu = 0,05 mol => VH2 = 22,4.0,05 = 1,12 lít.
Khí H2 cần dùng để khử Fe2O3 theo phương trình phản ứng (2) là: nH2 = 3/2nFe = 3/2.0,05 = 0,075 mol
=>VH2 = 22,4.0,075 = 1,68 (lít)
Bài 6
Cho các kim loại kẽm nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a. Viết các phương trình phản ứng.
b. Cho cùng một khối lượng các kim loại trên tác dụng hết với axit dư thì kim loại nào cho nhiều khí hiđro nhất?
c. Nếu thi được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
Giải bài 6
a. Phương trình phản ứng:
Zn + H2SO4 loãng → ZnSO4 + H2 ↑ (1)
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2 ↑ (2)
Fe + H2SO4 loãng → FeSO4 + H2 ↑ (3)
b. Theo các phương trình phản ứng (1), (2) và (3), cùng một lượng kim loại tác dụng với lượng axit dư thì kim loại nhôm sẽ cho nhiều khí hiđro hơn như sau:
Zn + H2SO4 loãng → ZnSO4 + H2 ↑ (1)
65g 22,4 lít
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2 ↑ (2)
2.27g = 54 g 3.22,4 = 67,2 lít
Fe + H2SO4 loãng → FeSO4 + H2 ↑ (3)
56g 22,4 lít
c. Nếu thu được cùng một thể tích khí hiđro (ví dụ là 22,4 lít) thì khối lượng kim loại nào nhỏ là nhôm (54/3 = 18g), tiếp theo là sắt (56g) và cuối cùng là kẽm (65g).