Bài 1 (trang 71 SGK Hóa 9): Viết các phương trình hoa học biểu diễn các chuyển hóa sau đây:
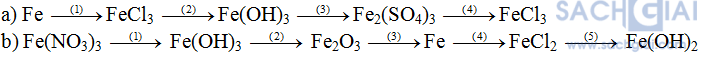
Giải:
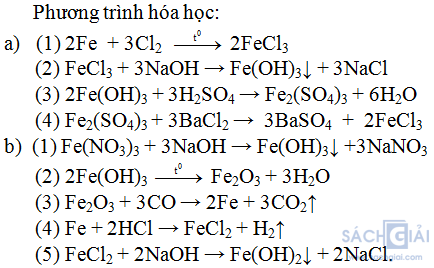
Bài 2 (trang 72 SGK Hóa 9): Cho bốn chất sau: Al, AlCl3, Al(OH)3, Al2O3. Hãy sắp xếp bốn chất này thành hai dãy chuyển hóa (mỗi dãy đều gòm 4 chất) và viết các phương trình hóa học tương ứng để thực hiện dãy chuyển hóa đó.
Giải:
Các dãy chuyển hóa có thể có:
Dãy biến hóa 1: Al → AlCl3 → Al(OH)3 → Al2O3
Dãy biến hóa 2: AlCl3 → Al(OH)3 → Al2O3 → Al

Bài 3 (trang 72 SGK Hóa 9): Có ba kim loại là nhôm, bạc, sắt. Hãy nêu phương pháp hóa học để nhận biết từng kim loại. Các dụng cụ hóa chất coi như có đủ. Viết các phương trình hóa học để nhận biết ba kim loại.
Giải:
– Cho dung dịch NaOH vào ba kim loại trên, kim loại nào tác dụng và có bọt khí bay lên là Al, hai kim loại còn lại (Fe, Ag) không tác dụng.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
- Cho dung dịch HCl vào hai kim loại Fe và Ag, kim loại nào tác dụng và có khí bay lên là Fe, kim loại nào không tác dụng là Ag.
Fe + 2HCl → FeCl2 + H2↑
Bài 4 (trang 72 SGK Hóa 9): Axit H2SO4 loãng phản ứng với tất cả các chất trong dãy chất nào dưới đây:
A. FeCl3, MgO, Cu, Ca(OH)2.
B. NaOH, CuO, Ag, Zn.
C. Mg(OH)2, HgO, K2SO3, NaCl.
D. Al, Al2O3, Fe(OH)3, BaCl2.
Giải:
Axit H2SO4 loãng phản ứng được với dãy chất: Al, Al2O3, Fe(OH)2, BaCl2 hay D đúng.
Bài 5 (trang 72 SGK Hóa 9): Dung dịch NaOH có phản ứng với tất cả các chất trong dãy nào sau đây:
A. FeCl3, MgCl2, CuO, HNO3.
B. H2SO4, SO2, CO2, FeCl2.
C. Al(OH)3, HCl, CuSO4, KNO3.
D. Al, HgO, H3PO4, BaCl2.
Giải:
Dung dịch NaOH phản ứng được với dãy chất: H2SO4, SO2, CO2, FeCl2 hay B đúng.
Bài 6 (trang 72 SGK Hóa 9): Sau khi làm thí nghiệm có những khí độc hại sau: HCl, H2S, CO2, SO2. Có thể dùng chất nào sau đây để loại bỏ chúng là tốt nhất?
A. Nước vôi trong.
B. Dung dịch HCl.
C. Dung dịch NaCl.
D. Nước.
Giải thích và viết phương trình phản ứng hóa học nếu có.
Giải:
Dùng phương án A, nước vôi trong là tốt nhất, vì nước vôi trong có phản ứng với tất cả các chất khí thải tạo thành chất kết tủa hay dung dịch.
Ca(OH)2 + 2HCl → CaCl2 + 2H2O.
H2S + Ca(OH)2 dư → CaS ↓ + 2H2O.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O.
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O.
Bài 7 (trang 72 SGK Hóa 9): Bạc (dạng bột) có lẫn tạp chất đồng, nhôm. Dùng phương pháp hóa học để thu được bạc tinh khiết.
Giải:
Cho hỗn hợp vào dung dịch AgNO3 dư, đồng và nhôm sẽ phản ứng, kim loại thu được là Ag.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
Al + 3AgNO3 → Al(NO3)3 + 3Ag ↓
Bài 8 (trang 72 SGK Hóa 9): Trong phòng thí nghiệm, người ta làm khô các khí ẩm bằng cách dẫn khí này đi qua các bình có đựng các chất háo nước nhưng không có phản ứng với khí cần làm khô. Có các chất làm khô sau: H2SO4 đặc, CaO. Dùng hóa chất nào nói trên để làm khô mỗi khí ẩm sau đây: Khí SO2, khí O2, khí CO2. Hãy giải thích sự lựa chọn đó.
Giải:
Có thể dùng H2SO4 đặc để làm khô các khí ẩm: SO2, CO2, O2 vì H2SO4 đặc không phản ứng với các khí này.
Có thể dùng CaO khan để làm khô khí ẩm O2. CaO khan tác dụng với khí ẩm SO2, CO2. Có thể xảy ra các phản ứng sau:
CaO + H2O → Ca(OH)2
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
Hoặc CaO + SO2 → CaSO3
CO2 + CaO → CaCO3
Bài 9: Cho 10g dung dịch muối sắt clorua 32,5% tác dụng với dung dịch bạc nitrat dư thì tạo thành 8,61g kết tủa. Hãy tìm công thức hóa học của muối sắt đã dùng.
Giải:
Gọi hóa trị của sắt trong muối là x.
mFeClx = 10 x 32,5 / 100 = 3,25g
Phương trình phản ứng hóa học:
FeClx + xAgNO3 → xAgCl ↓ + Fe(NO3)x
nAgCl = 8,61 / 143,5 = 0,06 mol.
nFeClx = 3,25 / (56 + 35,5x).
=> 0,06 = 3,25 / (56 + 35,5x).
Giải ra ta có x = 3. Vậy công thức hóa học của muối sắt clorua là FeCl3.
Bài 10: Cho 1,96g bột sắt vào 100ml dung dịch CuSO4 10% có khối lượng riêng là 1,12 g/ml.
a) Viết phương trình hóa học.
b) Xác định nồng độ mol của chất trong dung dịch khi phản ứng kết thúc. Giả thiết rằng thể tích của dung dịch sau phản ứng thay đổi không đáng kể.
Giải:
nFe= 1,96 / 56 = 0,035 mol
nCuSO4 = 100 x 1,2 x 10 / (100 x160) = 0,07 mol
a) Phương trình hóa học.
Fe + CuSO4 → FeSO4 + Cu ↓
nFe = nCuSO4 pu = 0,035 mol.
b) Nồng độ mol của các chất trong dung dịch:
nCuSO4 dư = 0,07 – 0,035 = 0,035 mol
CM(CuSO4) = 1000 x 0,035 / 100 = 0,35 mol/l
CM(FeSO4) = 1000 x 0,035 / 100 = 0,35 mol/l.