Bài 1 (trang 131 SGK Hóa 8): Tương tự như natri, các kim loại kali K và canxi Ca cũng tác dụng được với nước tạo thành bazơ tan và giải phóng khí hiđro.
a) Hãy viết các phương trình phản ứng xảy ra.
b) Các phản ứng hóa học trên thuộc loại phản ứng hóa học nào?
Giải:
a) Phương trình phản ứng xảy ra là:
K + H2O → KOH + H2.
Ca + 2H2O → Ca(OH)2 + H2.
b) Các phản ứng trên thuộc loại phản ứng thế.
Bài 2 (trang 132 SGK Hóa 8): Hãy lập phương trình hóa học của những phản ứng có sơ đồ sau đây:
a) Na2O + H2O → NaOH.
K2O + H2O → KOH.
b) SO2 + H2O → H2SO3.
SO3 + H2O → H2SO4.
N2O5 + H2O → HNO3.
c) NaOH + HCl → NaCl + H2O.
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O.
d) Chỉ ra loại chất tạo thành ở a), b), c) là gì? Nguyên nhân có sự khác nhau ở a) và b)
e) Gọi tên các chất tạo thành.
Giải:
Phương trình hóa học của phản ứng
a) Na2O + H2O→ 2NaOH. Natri hiđroxit.
K2O + H2O → 2KOH
b) SO2 + H2O → H2SO3. Axit sunfurơ.
SO3 + H2O → H2SO4. Axit sunfuric.
N2O5 + H2O → 2HNO3. Axit nitric.
c) NaOH + HCl → NaCl + H2O. Natri clorua.
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 3H2O. Nhôm sunfat.
d) Loại chất tạo thành ở a) (NaOH, KOH) là bazơ kiềm là loại chất tan ở b) (H2SO4, H2SO3, HNO3) là axit, ở c) (NaCl, Al2(SO4)3 là muối.
Nguyên nhân của sự khác biệt là ở a) là oxit bazơ (Na2O, K2O) tác dụng với nước cho bazơ còn ở b) là oxit axit ( SO2, SO3, N2O5) tác dụng với nước cho axit.
Bài 3 (trang 132 SGK Hóa 8): Viết công thức hóa học của những muối có tên gọi dưới đây:
Đồng (II) clorua, kẽm sunfat, sắt (III) sunfat, magie Hiđrocacbonat, canxi photphat, natri hiđrophotphat, natri đihiđrophotphat.
Giải:
Công thức hóa học của những muối:
CuCl2, ZnSO4, Fe2(SO4)3, Mg(HCO3)2, Ca3(PO4)2, Na2HPO4; NaH2PO4.
Bài 4 (trang 132 SGK Hóa 8): Cho biết khối lượng mol của một oxit axit kim loại là 160gam, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hóa học của oxit. Gọi tên oxit kim loại đó.
Giải:
Đặt công thức của oxit kim loại là MxOy
Khối lượng của kim loại trong oxit kim loại: 160.70/100 = 112g.
mx = 112 kẻ bảng ta có
| x | 1 | 2 | 3 |
| M | 112 (loại) | 56 (nhận) | 37,33 (loại) |
Khối lượng của oxit là 160 -112 = 48g.
16.y = 48 => y=3.
Vậy công thức hóa học của oxit kim loại là Fe2O3.
Bài 5 (trang 132 SGK Hóa 8): Nhôm (III) oxit tác dụng với axit sunfuric theo phương trình phản ứng sau:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tính lượng muối nhôm sunfat được tạo thành nếu đã sử dụng 49g axit sunfuric nguyên chất tác dụng với 60g nhôm oxit. Sau phản ứng chất nào còn dư? Lượng dư của chất đó là bao nhiêu?
Giải:
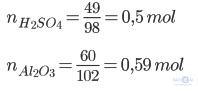
Phương trình hóa học của phản ứng:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
So sánh tỉ lệ 0,59/1 > 0,5/3 → Nhôm oxit dư, tính lượng Al2(SO4)3 theo H2SO4
Theo phương trình phản ứng trên
102g Al2O3 tác dụng với 294g H2SO4
Theo phương trình phản ứng trên
294g H2SO4 tác dụng với Al2O3 cho 342g Al2(SO4)3
Vậy 49g H2SO4 tác dụng với Al2O3 cho xg Al2(SO4)3
x= 49. 342 / 294 = 57g Al2(SO4)3