Bài 1. Viết công thức electron, công thức cấu tạo của axit nitric. Cho biết nguyên tố nitơ có hóa trị và số oxi hóa bao nhiêu?
Trả lời:
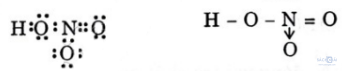
Trong HNO3, nitơ có số oxi hóa +5 và hóa trị là 4
Bài 2. Lập các phương trình hóa học:
a) Ag + HNO3 (đặc) → NO2 + ? + ?
b) Ag + HNO3 (loãng) → NO + ? + ?
c) Al + HNO3 → N2O + ? + ?
d) Zn + HNO3 → NH4NO3 + ? + ?
e) FeO + HNO3 → NO + Fe(NO3)3 + ?
g) Fe3O4 + HNO3 → NO + Fe(NO3)3 + ?
Trả lời: Trước hết, căn cứ vào tính chất, điền công thức các chất còn thiếu ở chỗ có dấu (?). Sau đó, cân bằng phương trình hóa học theo phương pháp thăng bằng electron, ta được kết quả sau:
a) Ag + 2HNO3 (đặc) → NO2 + AgNO3 + H2O
b) 3Ag + 4HNO3 (loãng) → NO + 3AgNO3 + 2H2O
c) 8Al + 30HNO3 → 3N2O + 8Al(NO3)3 + 15H2O
d) 4Zn + 10HNO3 → NH4NO3 + 4Zn(NO3)2 + 3H2O
e) 3FeO + 10HNO3 → NO + 3Fe(NO3)3 + 5H2O
g) 3Fe3O4 + 28HNO3 → NO + 9Fe(NO3)3 + 14H2O
Bài 3. Hãy chỉ ra những tính chất hóa học chung và khác biệt giữa axit nitric và axit sunfuric. Viết các phương trình hóa học để minh họa.
Trả lời: Axit nitric và axit sunfuric đặc đều có tính oxi hóa mạnh.
Ví dụ: 3FeO + 10HNO3 → 3Fe(NO3)3 + NO ↓ + 5H2O
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
Tuy nhiên nếu như HNO3 loãng vẫn có tính oxi hóa thì H2SO4 loãng lại không có tính oxi hóa.
Ví dụ:
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO ↓ + 14H2O
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
Bài 4.
a) Trong phương trình hóa học của phản ứng nhiệt phân sắt (III) nitrat, tổng các hệ số bằng bao nhiêu?
A. 5 B. 7 C. 9 D. 21
b) Trong phương trình hóa học của phản ứng nhiệt phân thủy ngân (II) nitrat, tổng các hệ số bằng bao nhiêu?
A. 5 B. 7 C. 9 D. 21
Trả lời
a) Chọn D. 21
4Fe(NO3)3 →t0 2Fe2O3 + 12NO2 + 3O2
b) Chọn A. 5
Hg(NO3)3 →t0 Hg + 2NO2 + O2
Bài 5. Viết phương trình hóa học của các phản ứng thực hiện dãy chuyển hóa sau đây:
NO2 → (1)HNO3 → (2)Cu(NO3)2 → (3)Cu(OH)2 → (4)Cu(NO3)2 → (5)CuO → (6)Cu → (7)CuCl2
Trả lời: Phương trình hóa học
4NO2 + 2H2O → 4HNO3
CuO + 2HNO2 → Cu(NO3)2 + H2O
Cu(NO3)2 + 2NaOH → Cu(OH)2 ↓ + 2NaNO3
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O
Cu(NO3)2 →t0 CuO + 2NO2 ↑ + ½ O2 ↑
CuO + H2 →t0 Cu + H2O
Bài 6. Khi hòa tan 30,0 g hỗn hợp đồng và đồng (II) oxit trong 1,50 lít dung dịch axit nitric 1,00 M (loãng) thấy thoát ra 6,72 lít nitơ monoaxit (đktc). Xác định hàm lượng phần trăm của đồng (II) oxit trong hỗn hợp, nồng độ mol của đồng (II) nitrat và axit nitric trong dung dịch sau phản ứng, biết rằng thể tích dung dịch không thay đổi.
Trả lời:
nNO = 6,72/22,4 = 0,300 (mol)
nHNO3 = 1,00 x 1,5 = 1,5 (mol)
pthh: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
Theo (1) ta tính được nCu = 0,45 mol => mCu = 28,8 gam
nHNO3 = 1,2 mol
nCu(NO3)2 = 0,45 mol
mCuO = 30 gam – 28,8 gam = 1,2 gam => nCuO = 0,015 mol
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
Theo (2) ta tính được nHNO3 là 0,030 mol,
nCu(NO3)2 là 0,015 mol
Phần trăm khối lượng CuO: % mCuO = 1,2/30.100% = 4,0%
Từ (1) và (2) ta tính được số mol HNO3 dư là 0,27 mol.
Nồng độ mol HNO3 sau phản ứng: 0,18 M
Nồng độ mol của Cu(NO3)2: 0,31 M
Bài 7. Để điều chế 5,000 tấn axit nitric nồng độ 60,0% cần dùng bao nhiêu tấn amoniac? Biết rằng sự hao hụt amoniac trong quá trình sản xuất là 3,8%.
Trả lời
Tính khối lượng HNO3 nguyên chất: 3,00 tấn.
Pthh: 4NH3 + 5O2 → (850 – 9000C)/Pt
4NO + 6H2O (1)
2NO + O2 → 2NO2 (2)
4NO2 + O2 + 2H2O → 4HNO3 (3)
Từ các phương trình trên ta có sơ đồ hợp thức: NH3 → HNO3 (4)
Theo (4), ta tính được khối lượng NH3 (hao hụt 3,8%): (3,00.17,0)/63,0 x (100/96,2) = 0,841 (tấn)